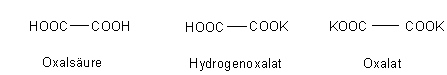
Salze der Oxalsäure
Experimente
Versuch: pH-Wert-Messung von Oxalsäure- und Oxalatlösungen
Versuch: Herstellung von Kleesalz aus Oxalsäure
Versuch: Herstellung von Calciumoxalat
Versuch: Nachweis von Oxalsäure als Calciumoxalat
Versuch: Gravimetrische Bestimmung von Oxalsäure und von Calcium
Versuch: Zersetzen von Oxalsäure durch Erhitzen
Versuch: Erhitzen von Kalium-, Natrium- und Calciumoxalat
Versuch: Erhitzen von Ammoniumoxalat
Als zweibasische Säure bildet Oxalsäure zwei Reihen von Salzen: Normale und saure Salze.
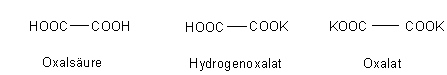
Wichtige Salze sind:
Ammoniumoxalat für die Analyse
Natriumoxalat als Urtitersubstanz für die Manganometrie (Oximetrie)
Kaliumhydrogenoxalat (Kleesalz)
Calciumoxalat
Kleesalz im Besonderen
Obwohl Kaliumhydrogenoxalat oftmals als Kleesalz bezeichnet wird, ist das nicht ganz richtig.
Das aus dem Sauerklee gewonnene Kleesalz ist eine zusammengesetzte Verbindung. Ihre Formel ist
(COOH)2 • (HOOC-COOK) • 2 H2O
Man spricht auch von Kaliumtetraoxalat.
Geschichtlich ist das Ganze interessant. Kleesalz war die erste Spur der Oxalsäure, auf die man stieß. Wegen der komplizierten Struktur hielt man damals die zugrunde liegende Säure für eine größere Verbindung. In alten Büchern stehen deshalb für die Oxalsäure noch abenteuerliche Zusammensetzungen wie im folgenden Text, der aus einem französischen Schulbuch* von 1875 stammt.

Hier ist als Formel für die Oxalsäure angegeben:
C4O6,2HO
Modern könnte man das näherungsweise wohl so schreiben: C4O8H2. Das entspricht in etwa dem oben erwähnten Tetraoxalat. Diese altertümliche Angabe der Formeln zeigt, dass das Schulbuch damals bereits veraltet war. Denn genau genommen war HO eine schon damals hoffnungslos überholte Bezeichnung für Wasser (was man 1875 schon besser wusste…). Die Formel C4O6,2HO spiegelt in aller Ratlosigkeit das Ergebnis der oben beschriebenen Reaktion zwischen Oxalsäure und Schwefelsäure wieder.
Man kann Kleesalz leicht herstellen (-> Versuch). Dazu nutzt man den Umstand aus, dass Kleesalz schlecht löslich ist. Bei 18 °C lösen sich nur 0,03 g in 100 ml Wasser. Dagegen ist das Kaliumoxalat KOOC-COOK gut löslich: Bei 20 °C lösen sich 36,4 g in 100 ml Wasser.
Die merkwürdigen Umstände der Herstellung von Kleesalz (schon einige Tropfen Kalilauge reichen aus, um in gesättigter Oxalsäurelösung eine Fällung zu bewirken) lässt auf seine kaliumarme Zusammensetzung (siehe oben!) schließen.
Calciumoxalat im Besonderen
Calciumoxalat ist schwerlöslich. Sein Löslichkeitsprodukt beträgt
L = 2 • 10-9 (20 °C)
Damit ist es wesentlich schwerer löslich als Gips (L = 2 • 10-4).
Diese Eigenschaft hat einige Folgen:
Weitere Oxalate
Natürlich bildet die Oxalsäure auch mit anderen Metall-Ionen Salze. Zu nennen sind vor allem Silber, Kupfer,
Aluminium und Blei. Aluminiumoxalate sind wichtig bei verschiedenen Eloxalverfahren.
Aber auch Eisenverbindungen haben große technische Bedeutung erlangt. Dabei bilden sich vor allem lösliche,
anionische Komplexverbindungen: Oxalato-ferrate, denen wir eine eigene
Webseite widmen.
Erhitzen von Oxalaten
Oxalsäure kann rückstandsfrei erhitzt werden. Die Dämpfe brennen mit bläulicher Flamme (->
Versuch).
Erhitzt man Kleesalz, so bleibt Pottasche zurück (-> Versuch). Bei Natriumoxalat erhält man Soda, mit Calciumoxalat Calciumcarbonat. Die Carbonate kann man durch Ansäuern nachweisen, denn dann bildet sich anders als bei den Oxalaten CO2.
Erhitzt man Ammoniumoxalat, so verschwindet wie bei der Oxalsäure alles restlos (-> Versuch).
pH-Werte der Oxalat-Lösungen
Die Hydrogenoxalate reagieren wegen des vorhandenen Protons schwach sauer.
Die gesättigten Salze reagieren anders. Als Salze einer schwachen Säure unterliegen Natrium- und
Kaliumoxalat-Lösungen der Hydrolyse – vor allem in der zweiten Dissoziationsstufe. Ihre Lösungen zeigen
deshalb ein alkalisches Milieu. (Zu den Hintergründen und Berechnungen der entsprechenden pH-Werte
lies hier.)
Ammoniumoxalat dagegen reagiert eher neutral, da die zweite Dissoziationsstufe und das Ammoniak quasi
spiegelbildlich reagieren.
Das Ganze erinnert ein wenig an die Verhältnisse bei der Essigsäure und ihrer Salze, der Acetate.
(Klicke hier.)
Literatur:
J. Langlebert: Manuel de Chimie. Rédigè d´après les Programmes officiels des Lycées prescrits
pour les examens du Baccalauréat. Paris 1875 (25. Auflage).
Weitere Texte zum Thema "Oxalsäure"