Prof. Blumes Tipp des Monats Januar 2011 (Tipp-Nr. 163)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Kork
Weihnachten und auch Silvester gilt: „Süßer die Glocken nicht klingen“. Oder klingen vielmehr die Wein- oder Champagner-Gläser?
Vor dem Trink- und Schlürfgenuss kommt das Korkenziehen. Auch wenn mittlerweile sogar auch bei sehr guten Weinen und Champagnersorten der zunehmende Ersatz von natürlichen Korken durch Kunststoffpropfen oder Schraubverschlüsse akzeptiert wird, widmen wir uns in diesem Tipp des Monats dem Propfen aus echtem Kork, also dem Korken im engeren Sinne. Sozusagen als Nachruf…

Bild 1: Korken edler Weine (Dank an Wolfgang Eisfeld)
(Foto: Blume)
Woher der Kork stammt
Kork ist im besten Sinne des Wortes ein Nachwachsender Rohstoff. Es
handelt sich um die Rinde der Korkeiche (Quercus suber). Eigentlich enthält die Rinde eines jeden Baums Kork.
Bei der Korkeiche ist die Schicht aber ausnehmend dick und kann abgeschält werden.
Die Korkeiche ist ein immergrüner und etwas unansehnlicher Baum, den man im westlichen Mittelmeerraum, vor allem aber in Portugal und Südspanien, aber auch auf Korsika sowie in Nordafrika findet. Anders als man erwarten würde, gibt es keine Plantagen, sondern nur lockere Wäldchen.

Bild 2: Korkeichenhain in Portugal
(Foto: Alex Blume)
Man erkennt Korkeichen leicht an den glatten roten Stämmen. Das lässt einen staunen, denn wie alle Eichen sollten
auch die Korkeichen eigentlich eine schrundige Rinde haben - für letztere sollte das besonders zutreffen.

Bild 3: Geschälte Korkeiche
(Foto: Alex Blume)
Die rote Farbe des glatten Stamms zeigt an, dass die Korkeiche vor kurzem geschält worden ist. Die vorsichtige und
daher für die Korkeiche folgenlose Schälbarkeit ist die Grundlage für die Korkgewinnung. Hier sind Bilder von frisch abgeschälter Korkrinde.

Bild 4: Stück der Rinde einer Korkeiche; Dicke 5 cm
(Dank an Alex; Fotos: Blume)
Bei der Ernte der Korkrinde gehen die Leute behutsam vor und achten vor allem darauf, dass die rote Kambiumschicht
(Phellogen), aus der die neue Korkrinde nachwächst, nicht verletzt wird. Dann heißt es warten: Korkeichen
benötigen etwa acht bis zehn Jahre, bis sie erneut entrindet werden dürfen.
Die großen Korkplatten werden danach einige Tage gewässert. Zum Schluss werden sie in Wasser erhitzt. Dadurch nimmt das Volumen um etwa 1/3 zu. Nach Druckbehandlung und Trocknen sind die Platten fertig zur technischen Verwertung.
Woher das Wort „Kork“ stammt
In Rom gab es schon eine Bezeichnung für die Korkeiche bzw. Korken, die gar nicht nach unserem Wort klingt:
Suber. Daher stammt der wissenschaftliche Name der Korkeiche, Quercus suber.
In unserem Sprachbereich ist das Wort Kork auf das lateinische Wort cortex, Rinde, zurückzuführen. Daraus wurde das spanische corcho.
Die Eigenschaften von Kork
Kork schließt mit seinem Gewebe besonders viel Luft ein und weist deshalb eine geringe Dichte (r
= 0,12-0,20 g/cm3) auf. Grund ist seine schaumige Zellstruktur, die wohl jeder Schüler im Biounterricht beim Arbeiten
mit einem Mikroskop schon mal gesehen hat. Das eingeschlossene Luftpolster beschert dem Kork Wärme- und Schalldämmungseigenschaften,
wie sie auch synthetische Schäume (z. B. Polystyrol oder Polyurethan)
aufweisen.
Wenn man Kork berührt, hat man das Gefühl, dass es sich um eine wachsartige Masse handelt. Dazu ist er Wasser abweisend und überhaupt undurchlässig für Wasser. Deshalb kann man damit Weinflaschen verschließen: Der Wein verdunstet nicht und läuft auch nicht aus. Und auch der Alkohol bleibt erhalten, denn Kork lässt keine organischen Lösemittel passieren. Da Kork undurchlässig für Luft ist, schützt er den Wein vor Oxidation.
Kork ist chemisch sehr stabil, wenn man von der direkten Einwirkung von aggressiven Chemikalien wie konzentrierter Schwefelsäure, Salpetersäure oder Natronlauge absieht.
Hinzu kommt, dass Kork schwer entflammbar ist. Er ist außerdem lichtecht und stabil gegen Ozoneinwirkung.
Kork ist mechanisch stabil. So kann man ihn in sehr dünne Schichten schneiden. Er ist hochelastisch, denn er lässt sich zu beliebigen Formen pressen und nimmt nach Druckentlastung die alte Form wieder an. Das ist z. B. beim Verschließen von Champagnerflaschen von Vorteil. (Wie man das macht, berichten wir hier.)
Aus Kork macht man aber nicht nur Flaschenverschlüsse. Aus Kork macht man zum Beispiel Schuhsohlen; deshalb nannte man früher die Korkeiche auch Pantoffelbaum.

Bild 5: Schuhe mit Korksohle
(Foto: Blume)
Viele dieser für uns Menschen interessanten Eigenschaften nutzen letztlich natürlich auch der Eiche selbst: So schützt die
Korkrinde den Baum vor zu starker Bestrahlung, vor Austrocknung und Feuer. Gerbstoffe schützen vor Insektenfraß. Die mechanische
Zähigkeit und Elastizität des Korks schützt ihn vor Rissen, die die Schutzhülle verletzen könnten.
Wie Kork chemisch zusammengesetzt ist
Mit 50 % Massenanteil ist Suberin der Grundstoff von Kork. Auch wenn man noch gar nicht so richtig weiß, wie
genau diese Substanz aufgebaut ist, kann man doch Folgendes sagen: Es handelt sich um einen dreidimensional angelegten Polyester,
der durch die zwischenmolekulare Verknüpfung von Hydroxy-di-carbonsäuren entsteht - ohne weitere Alkoholkomponenten wie bei den
Triglyceriden oder Wachsen.
Diese Erkenntnis wird gestützt durch die Ergebnisse bei der Oxidation von Kork mit konzentrierter Salpetersäure. Dabei entsteht die Korksäure, bekannt auch als Suberinsäure, chemisch korrekt Octan-di-carbonsäure HOOC-(CH2)6-COOH. Sie spielt eine wichtige Rolle bei der Synthese von Polyamiden wie Nylon und wird deshalb heute synthetisch hergestellt.
Hinzu kommen Wachse. Das sind stark Wasser abweisende Ester aus langkettigen Fettsäuren mit langkettigen einwertigen Alkoholen. Beispiele aus der Kosmetikchemie zeigen wir hier.
Weitere Bestandteile sind typische Holzinhaltsstoffe wie Lignin und Cellulose. Gerbstoffe (Tannine) färben die Korken mehr oder weniger braun.
Chemische Versuche mit Kork
Wenn wir mit Kork und Korken arbeiten, muss man bedenken, dass es mittlerweile Kork-Imitate aus Kunststoff gibt.
Weil Kork so schwer benetzbar und dazu noch chemisch inert ist, gibt es eigentlich nicht viele Experimente, die man damit machen kann. Hier ein paar Vorschläge - zum Beispiel für eine Facharbeit.
|
Versuch 1: Verbrennen von Kork
|
Mit den schmierigen Brandresten kann man auf Kinderfesten allerlei Schabernack treiben. Auch in Tatis Film „Schützenfest“ spielen sie eine entsprechende Rolle.


Bilder 6 und 7: Verbrannter Kork
(Fotos: Blume)
Dieser Versuch zeigt (wie auch der nächste), dass Kork aus organischem Material, also aus Kohlenstoffverbindungen besteht.
|
Versuch 2: Kork und Schwefelsäure
|
Schwefelsäure entreißt den chemischen Verbindungen, die das Korkmaterial aufbauen, Wasser. Zurück bleibt der Kohlenstoff. Zum chemischen Ablauf klicke hier.
|
Versuch 3: Laugenstabilität von Kork
|
Als Ester ist auch Suberin empfindlich gegen Natronlauge. Während der Verseifung werden die löslichen Natriumsalze der beteiligten Säuren sowie langkettige Alkohole gebildet. Beim Verdünnen fallen einige der Alkohole aus. Beim Ansäuern flocken zusätzlich die schwerlöslichen undissoziierten Säuren aus, so dass sich die Menge an Niederschlag deutlich erhöht.
|
Versuch 4: Behandlung von Kork mit Salzsäure
|
Der Versuch ist ein Hinweis auf das Vorliegen von Cellulose, die durch die Salzsäure in reduzierende Glucose gespalten wird.
|
Versuch 5: Ligninnachweis mit Kork
|
Da der Ligninanteil nicht besonders hoch ist, ist die Färbung nicht so intensiv wie bei Holz.

Bild 8: Kork nach Behandlung mit Lignin-Nachweisreagenz
(Foto: Blume)
|
Versuch 6: Nachweis von Gerbstoffen in Kork
|

Bild 9: Nachweis von Gerbstoffen in Kork. Links Wasser/FeCl3, rechts Reaktionslösung/FeCl3
(Foto: Daggi)
Zur Erklärung der „Tintenbildung“ klicke hier.
Modellversuche zur Suberinsynthese
Die folgenden Versuche zeigen modellhaft, wie man auch im Schullabor plastikartige Verbindungen wie das Suberin aus
Hydroxycarbonsäuren herstellen kann.
|
Versuchsgruppe 7: Modellexperimente zum Aufbau von Suberin
2. Die Herstellung eines Polyesters auf der Basis von Ricinolsäure, einer Hydroxycarbonsäure, und Adipinsäuredichlorid zeigen wir mit diesem Versuch. 3. Man kann auch Hydroxycarbonsäuren wie Citronensäure und Hydroxycarbonsäurederivate wie Ricinusöl zu einem Polyester reagieren lassen (-> Versuch). |
Verwendung von Kork im chemischen Labor
Wie bedeutsam war früher der Korkstopfen für die chemische Arbeit, als man noch keine Gummi- oder Kunststoffstopfen kannte! Jeder
Student hat früher über die Korkbohrerei geflucht und dann mit den hochgefährlichen Glasrohren gekämpft, die er durch die Bohrung schieben
musste. Die mussten eng sitzen; das Dichtigkeitsproblem war ständiger Begleiter chemischen Arbeitens. Viele Schullabore haben in ihren
hinteren Ecken sicherlich noch schöne Korkexemplare herumliegen.
So beständig, wie es immer gesagt wird, waren die Korken im Laboralltag aber keineswegs: Kork im Kontakt mit Schwefelsäure wird bald unansehnlich und schwarz. Auch mit konzentrierter Salpetersäure zersetzt sich der Kork. Unter ständiger Lösemitteleinwirkung wird er brüchig.
Lohnt es sich, Kork zu recyceln?
Korkeichen lassen sich nicht in Plantagen züchten, und es werden immer weniger. Also lohnt sich das Recyceln - vor allem schon
deshalb, weil man daraus viele Produkte herstellen kann. Das gilt auch für die Abfälle, die bei der Verarbeitung von Kork anfallen.
Daraus macht man Matten, Tapeten, Dichtungen für Motoren, Pinnwände, Schall- und Wärmeisoliermaterial sowie Füllstoff für isolierende „Korksteine“ oder Linoleum. Aus diesem Grunde sollte man Korken nicht wegwerfen oder verbrennen, sondern sammeln oder zusammen mit den Flaschen in den Glascontainer werfen.
Letztlich macht man auch Flaschenkorken aus zerkleinertem Recyclinggut, wie das folgende Bild zeigt.

Bild 10: Sektkorken aus Recycling-Kork
(Foto: Blume)
Solche Korken sind bei Weinkennern nicht gerade beliebt, weil man meint, dass man die Korkstückchen mit Klebstoffen zusammengefügt
hat, was zu Aromafehlern führen könnte. Um das zu verhindern, besteht die Kontaktfläche zwischen dem Recyclingmaterial und Sekt aus einer
frischen, ungebrauchten Korkscheibe (siehe Bild 10). Das Stichwort „Aromafehler“ leitet uns zur nächsten Frage über:
Welchen Geschmack hat Kork?
Wie ist das eigentlich mit dem „korkigen Geschmack“ bei Weinen? Kork schmeckt nämlich nach nichts. Es handelt sich um einen so
genannten „Aromafehler“. Der beruht auf duftenden Fremdsubstanzen, die von außen in den Wein eingewandert sind. (Genau genommen handelt
es sich gar nicht um einen korkigen Geschmack, sondern um einen korkigen Geruch.)
Als Verursacher für diesen speziellen Aromafehler stellten sich bei genaueren Untersuchungen schon in geringsten Spuren (unter 1 ppb) wahrnehmbare chlorierte Phenolderivate wie 2,4,6-Chloranisol heraus.
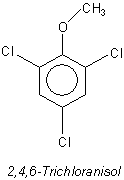
Anisol ist der Methyl-phenol-ether. Dieser Ether ist typisch als Baustein von Lignin oder Gerbsäuren. Folglich entsteht Chloranisol, wenn Holz oder Kork mit chlorhaltigem Wasser behandelt werden - zum Beispiel, um den Korken zu bleichen oder auch nur zu waschen. Auch das Desinfektionsmittel bzw. Holzschutzmittel Pentachlorphenol wird als Auslöser diskutiert, seit man weiß, dass 2,4,6-Chloranisol ein (wenn auch erstaunliches) Abbauprodukt seines mikrobiologischen Abbaus ist.
Denken muss man aber auch an mikrobiologische Bildungen wie Geosmin oder Methylisoborneol (Frage 1857), die für erdige oder muffige Geruchsnoten sorgen. Diese stammen aus der muffigen Luft von alten Kellern.
Deshalb entsteht der korkige Geschmack vor allem bei Weinen, die längere Zeit in Holzfässern oder in alten Weinkellern gelagert wurden. Hinzu kommt die von vielen „Weinkennern“ bevorzugte Lagerung von Wein in liegenden Flaschen, was zum Kontakt des Weins mit den möglicherweise kontaminierten Korken führt.
Und was hat es mit dem verkorksten Magen auf sich?
Der war wahrscheinlich die Folge einer schlecht verschlossenen („verkorkten“) Flasche, was erst zum Verderb des Inhalts
und anschließend zu dem des Magens führte.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 08. Januar 2012, Dagmar Wiechoczek