| Klick mich an! |
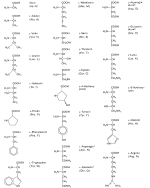 |
| Die wichtigsten Aminosäuren und ihre Abkürzungen |
Proteine - die Bausteine des Lebens - allgemeine Grundlagen
Experimente:
Versuch: Erhitzen von getrocknetem Eiweiß
Versuch: Nachweis von gebundenem Stickstoff in organischen Verbindungen
Versuch: Nachweis von Stickstoff und Schwefel im Protein
Versuch: Nachweis von freien Aminogruppen in Proteinen
Versuch: Biuret-Reaktion
Versuch: Xanthoprotein-Reaktion
Versuch: Nachweis von Aminosäuren: Die Ninhydrin-Reaktion
Versuch: Fällung von Proteinen durch verschiedene Einflüsse
Eiweiße, die Proteine (von griechisch: proteios = erstrangig), sind an vielen
Strukturen und Funktionen eines Organismus beteiligt. Sie sind die vielseitigsten Biomoleküle
und daher Grundstoffe des Lebens. Schon Bakterien besitzen mehrere tausend verschiedene
Proteinmoleküle, die unterschiedliche lebensnotwendige Aufgaben innerhalb der Zelle wahrnehmen.
Den menschlichen Körper bauen wahrscheinlich bis zu 100.000 verschiedene Proteine auf.
Beispielsweise treten sie als Enzyme oder Hormone in Erscheinung und
sorgen so dafür, dass Reaktionen überhaupt erst stattfinden können und für uns wichtige Informationen
- auch von außen - durch Botenstoffe übertragen werden. Unsere Muskeln bestehen zu einem großen Teil
aus Proteinen und unsere Haut enthält elastische Proteinfasern. Im Unterschied zu diesen unlöslichen
Gerüstproteinen übernehmen die wasserlöslichen Proteine wichtige Aufgaben im Stoffwechsel.
Auch durch die Nahrung nehmen wir eine Vielzahl von Proteinen auf, die durch die Verdauung
zu körpereigenem Eiweiß umgeformt werden. Insbesondere Milch
ist hinsichtlich der Proteinzufuhr eines der wichtigsten Grundnahrungsmittel überhaupt
(Proteine der Milch). In vielen Lebensmitteln liegen die Proteine
nicht mehr in ihrer ursprünglichen, d. h. natürlichen Form vor, sondern sind durch die Bearbeitung
(Erhitzen, Ansäuerung etc.) in ihrer räumlichen Gestalt verändert worden.
Man bezeichnet diese Veränderung in der Gestalt und dadurch bedingt im chemischen Verhalten als
Denaturierung.
Wie sind Proteine zusammengesetzt?
Alle Eiweiße bestehen aus Makromolekülen mit einem Molekulargewicht zwischen 6000
und über 100.000 g/mol.
Proteine, die aus den fünf Elementen Wasserstoff, Kohlenstoff, Sauerstoff,
Stickstoff und Schwefel bestehen, bezeichnet man als einfache Eiweiße
oder einfache Proteine. Enthalten sie noch weitere Bestandteile wie
Phosphor, Eisen, Farbstoffe
usw., so bezeichnet man sie als zusammengesetzte Eiweiße oder
Proteine.
Bausteine für Proteine: Aminosäuren
Die natürlich vorkommenden Proteine - also auch die im menschlichen Körper - bestehen aus
zwanzig verschiedenen Aminosäuren:
| Klick mich an! |
 |
| Die wichtigsten Aminosäuren und ihre Abkürzungen |
Von den zwanzig in natürlichen Eiweißen vorkommenden Aminosäuren sind acht für den Menschen
essentiell (in der Abbildung mit einem Sternchen gekennzeichnet).
Diese essentiellen Aminosäuren, zu denen Valin,
Leucin, Isoleucin, Phenylalanin, Tryptophan, Lysin, Threonin und Methionin gehören, können
vom menschlichen Organismus nicht selbst synthetisiert werden, weil ihm unter anderem die
entsprechenden Enzyme fehlen. Da diese Aminosäuren jedoch für den Aufbau von körpereigenen Proteinen
benötigt werden, bleibt dem Menschen nichts anderes übrig, als diese Aminosäuren mit der Nahrung
aufzunehmen.
Vielleicht ist dir beim Betrachten der Abbildung und beim Vergleichen der Moleküle aufgefallen, dass alle
Aminosäuren eine ähnliche Grundstruktur aufweisen:
Alle Aminosäuren besitzen an einem Kohlenstoffatom eine Aminogruppe
-NH2, eine Säuregruppe -COOH - daher der Name
Aminosäure - und ein Wasserstoffatom -H. Lediglich der
Rest -R, der auch als Seitenkette bezeichnet
wird, kann variieren. Die Seitenketten unterscheiden sich in ihrer
Säure-Base-Eigenschaft, ihrer Polarität und ihrer Ladung.
Der Rest -R kann im einfachsten Fall aus einem einzelnen Wasserstoffatom (bei Glycin) oder aber aus verschiedenen Atom- oder funktionellen Gruppen bestehen. Trägt ein C-Atom vier verschiedene Atomgruppen, so handelt es sich um ein asymmetrisches C-Atom (C*). Dadurch bekommt ein Molekül eine neue Eigenschaft, nämlich eine Chiralität. Das Molekül kann dann in zwei verschiedenen Raumstrukturen - den optischen Isomeren - angeordnet sein, die man nicht zur Deckung bringen kann. Sie verhalten sich wie ein Bild zu seinem Spiegelbild oder wie die rechte Hand zur linken. Gekennzeichnet wird das durch ein großes D (von lateinisch: dexter) oder L (von lateinisch: laevus). Bezogen auf Aminosäuren gibt es also D- und L-Aminosäuren, wie z. B. D- und L-Alanin. Als Bausteine von Proteinen findet man interessanterweise nur L-Aminosäuren.
Optische Isomere weisen die gleichen chemischen Eigenschaften auf, verhalten sich aber gegenüber polarisiertem Licht unterschiedlich. Die eine Molekülsorte dreht die Schwingungsebene des polarisierten Lichts nach rechts (+), die andere um den gleichen Betrag nach links (-). Man bezeichnet das Phänomen als optische Aktivität, die man in speziellen Geräten, den Polarimetern, messen kann. Eine optische Aktivität findet man bei vielen anderen Substanzklassen auch, so z. B. bei den Zuckern oder auch bei der Milchsäure.
Da die meisten Aminosäuren durch die Carboxylgruppe einen sauren und durch die Aminogruppe einen basischen Teil im Molekül enthalten, bilden sie in wässriger Lösung Zwitter-Ionen. Der pH-Wert, bei dem das Gleichgewicht aus Zwitter-Ion und undissoziierter Aminosäure vorliegt, bezeichnet man als Isoelektrischen Punkt. Klicke hier.
Die chemischen Elemente in einem Protein lassen sich mit ganz einfachen Versuchen nachweisen. Erhitzt du z. B. gut eingetrocknetes Eiklar oder besser noch Trockengelatine in einem Reagenzglas, so stellst du fest, dass sich an der Wandung des Glases Kondenswasser bildet. Das bedeutet, dass Wasserstoff und Sauerstoff in einem ganz bestimmten Mengenverhältnis im Protein enthalten sind. Ein noch stärkeres Erhitzen führt zur Verkohlung und damit zum Nachweis von Kohlenstoff.
Beim Nachweis von Aminogruppen und Schwefel im Eiklar nutzt du die Flüchtigkeit von Ammoniak aus, das sich aus der Aminogruppe gebildet hat und das du durch den Geruch und durch das sich blau färbende Lackmuspapier nachweisen kannst. Du kannst zum Nachweis aber auch die C-N-Bindung ausnutzen: Beim Erhitzen mit Natrium bildet sich Cyanid, das mit der Berliner Blau-Reaktion nachgewiesen wird.
Freie Aminogruppen weist man durch Reaktion mit Nitrit nach. Dabei kommt es zu einer Stickstoffeliminierung.
Das Bleiacetat-Papier wird durch sich bildendes Bleisulfid silbergrau bis schwarz verfärbt - ein eindeutiger Hinweis auf die Anwesenheit von Schwefel in der Protein-Probe.
a-Aminosäuren lassen sich auch mit Hilfe der Ninhydrin-Reaktion nachweisen. Erwärmst du eine Protein-Probe, die du zuvor mit Ninhydrin-Lösung versetzt hast, kommt es zu einer Blauviolettfärbung. Das Ninhydrin reagiert dabei mit der Aminosäure zu einem Zwischenprodukt, das dann über ein Hydrolyse-Produkt zu einem Farbstoff reagiert. Der Nachweis mit Ninhydrin wird bei der Dünnschicht-Chromatographie zum Nachweis kleinster Aminosäuremengen verwendet. Eine weitere Anwendung der Ninhydrin-Reaktion finden Sie hier.
Zum Nachweis der aromatischen Aminosäuren, wie z. B. Tryptophan oder Tyrosin, versetzt du eine Protein-Probe mit konzentrierter Salpetersäure. Es tritt eine Gelbfärbung auf, die bei dieser Xanthoprotein-Reaktion auf die Nitrierung des Benzolkernes zurückzuführen ist. Fügst du noch etwas Natronlauge hinzu, so vertieft sich die Farbe bis hin zu orange. Beim Alkalisieren kommt es zur Salzbindung des Nitrophenolrestes.
Bildung von Di-, Oligo- und Polypeptiden: die Peptidbindung
Aminosäuren werden über Peptidbindungen zu Di-, Oligo- und Polypeptiden
miteinander verknüpft.
Eine Peptidbindung wird gebildet, indem sich die Carboxylgruppe (Säuregruppe) der einen Aminosäure
mit der Aminogruppe einer anderen Aminosäure unter Wasserabspaltung verbindet:
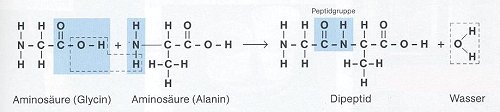
(Quelle: Cornelsen)
Für die Anwesenheit von Peptidbindungen (-CO-NH-) gibt es sogar eine spezifische Nachweisreaktion,
die Biuret-Reaktion. Die Reaktion ist für alle Verbindungen spezifisch,
die mehrere Peptidbindungen im Molekül besitzen, also wie geschaffen für Proteine und Peptide.
Der Nachweis ist positiv, wenn bei der Zugabe der Kupfersulfatlösung eine Violettfärbung auftritt.
Die Färbung beruht auf der Reaktion der Peptidbindung mit Kupfer zu einem Kupfer-Eiweiß-Komplex.
Je nach Anzahl der verknüpften Aminosäuren unterscheidet man:
- Oligopeptide: 2-9 Aminosäuren
- Polypeptide: 10-100 Aminosäuren
- Makropeptide oder Proteine: Mehr als 100 Aminosäuren
Proteine können aus einer oder auch aus mehreren Polypeptidketten gebildet werden.
Durch die Anzahl und Reihenfolge der Aminosäuremoleküle erhält jedes Protein eine ganz bestimmte charakteristische räumliche Gestalt (Konformation). Erst in dieser Anordnung sind Proteine biologisch aktiv. Wie schon oben erwähnt, kann man die Konformation durch Denaturieren verändern. Bei der Bearbeitung von Lebensmitteln spielt das eine ganz wichtige Rolle.
Weitere Texte zum Thema „Milch“