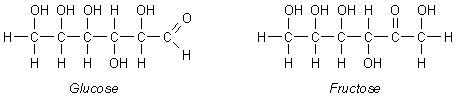
Kohlenhydrate
I. Monosaccharide (Einfachzucker)
II. Disaccharide
III. Süßstoffe
IV. Stärke (Polysaccharide)
V. Cellulose (Polysaccharid)
Zucker, Stärke und Cellulose gehören zu den Kohlenhydraten.
Sie sind Verbindungen aus den Elementen Kohlenstoff, Wasserstoff und
Sauerstoff. Obwohl Zucker, Stärke und Cellulose zum Teil
unterschiedliche Eigenschaften zeigen, haben sie eines gemeinsam:
In den Molekülen aller Kohlenhydrate kommen Wasserstoff- und
Sauerstoffatome im Verhältnis 2:1 vor. Dies entspricht der
allgemeinen Summenformel Cx(H2O)y, weshalb man sie ursprünglich
für Verbindungen des Kohlenstoffs mit Wasser, also für
Hydrate des Kohlenstoffs hielt. So gab man ihnen den Namen Kohlenhydrate.
Bei "echten" Hydraten lässt sich das Wasser aus den Verbindungen
(z. B. durch Erwärmen) austreiben, wobei dieser Prozess der
Wasserabspaltung leicht rückgängig gemacht werden kann
(z. B. Cobaltchlorid-Papier).
Zerlegt man Kohlenhydrate in Wasser
und Kohlenstoff ist dieser Vorgang nicht umkehrbar, weshalb man heute
für Kohlenhydrate Summenformeln verwendet, durch die die Anwesenheit
von Wasser nicht mehr vorgetäuscht wird (z. B. für Traubenzucker
C6H12O6).
Versuch:
Untersuchen von Kohlenhydraten auf die Elemente Kohlenstoff und Wasserstoff
I. Monosaccharide (Einfachzucker)
Früchte und Honig enthalten Glucose (Traubenzucker)
und Fructose (Fruchtzucker).
Bild 1: Molekülstrukturen von Glucose und Fructose
Beide Monosaccharide bestehen aus sechs Kohlenstoffatomen und
fünf Hydroxygruppen, die eine gute Wasserlöslichkeit beider
Zucker bewirken und zudem den süßen Geschmack hervorrufen.
Dennoch unterscheiden sich beide Zucker in ihrer Struktur. Das
Glucosemolekül enthält eine Aldehydgruppe (CH=O-Gruppe),
während das Fructosemolekül über eine Ketogruppe
(C=O-Gruppe) verfügt. Beide Gruppen wirken reduzierend. Da Glucose
und Fructose trotz unterschiedlicher Struktur die gleiche Summenformel
haben (C6H12O6), nennt man sie
Isomere.
Versuche:
Nachweis von Glucose (Traubenzucker) und Fructose (Fruchtzucker)
Untersuchen von Früchten auf Glucose und Fructose
Untersuchung von Honig auf Glucose und Fructose
Nachweis von Glucose und Fructose mit der Silberspiegel-Probe
Nachweis von Hydroxygruppen in Traubenzucker
Glucose- und Fructosemoleküle können Ringe bilden. Unter Einwirkung saurer Reagenzien verbindet sich die Aldehydgruppe mit der Hydroxygruppe am Kohlenstoffatom 5 (Bild 2). An ihrer Stelle entsteht eine neue Hydroxygruppe, die aufgrund der benachbarten Stellung des Kohlenstoffatoms 1 andere Eigenschaften als die übrigen Hydroxygruppen besitzt und deshalb glykosidische Hydroxygruppe genannt wird.
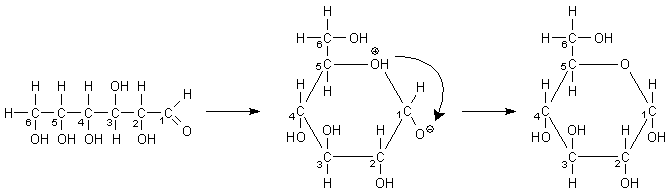
Bild 2: Ringbildung von Glucose
Versuch:
Verhalten von Glucose in Säuren
Ringförmige Glucosemoleküle kommen in der Natur in zwei isomeren Strukturen vor, da die glykosidische Hydroxygruppe entweder die
a- oder die b-Stellung einnehmen kann.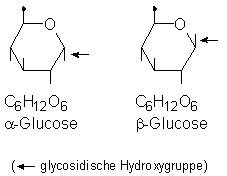
Bild 3: Molekülstrukturen von a- und b-Glucose
II. Disaccharide
Disaccharide bestehen aus zwei kondensierten, ringförmigen
Monosacchariden. Haushaltszucker, der aus Zuckerrüben oder Zuckerrohr
gewonnen werden kann, besteht aus einem Glucosemolekül, welches
über ein verbrücktes Sauerstoffatom mit einem Fructosemolekül
verbunden ist und heißt Saccharose.
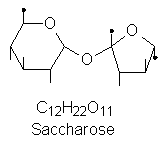
Bild 4: Molekülstruktur von Saccharose
Versuche:
Gewinnen von Zucker aus Zuckerrüben
Herstellen von Zuckerglas
Durch saure Hydrolyse können Disaccharide in ihre Monosaccharide gespalten werden.
Versuche:
Hydrolyse von Saccharose
Herstellen von Kunsthonig
Weitere Disaccharide sind Maltose (Malzzucker) und Lactose (Milchzucker).
Versuche:
Nachweis von Lactose in Milch
Nachweis von Glucose in Milchzucker (Lactose)
Aus Glucose oder auch Saccharose kann Ethanol, ein Alkohol, durch Vergären mit Enzymen gewonnen werden. Ihre funktionelle Gruppe ist die Hydroxygruppe (OH-Gruppe).
Versuche:
Vergären von Traubenzucker
Nachweis von Alkoholen in Spirituosen und Kosmetika
Daneben gibt es auch Alkohole mit längerer oder verzweigter Molekülstruktur. Mehrwertige Alkohole, wie z. B. Glycerin, besitzen mehrere Hydroxygruppen.
Versuche:
Nachweis von Glycerin in Feuchtigkeitscreme
Hygroskopisches Verhalten von Glycerin
III. Süßstoffe
Künstlich hergestellte Süßungsmittel sollen den
süßen Geschmack von Zuckern bei der Lebensmittelzubereitung
ersetzen, so dass diese auch für Diabetiker oder Diäten geeignet
sind. Sie besitzen je nach Süßstoff eine 30- bis 200fache
Süße der gleichen Menge Saccharose. Einer der ältesten
Süßstoffe ist das Saccharin. Inzwischen wurden weitere
Süßstoffe, wie das Cyclamat, das Acesulfam und Aspartam®
entwickelt. Sie unterscheiden sich in ihrem chemischen Aufbau deutlich von
den Kohlehydraten. Obwohl alle Süßstoffe einen süßen
Geschmack hervorrufen, kann die menschliche Zunge den geschmacklichen
Unterschied zu natürlichen Zuckern unterscheiden. Aus diesem Grund
wird einigen diätischen Lebensmitteln zusätzlich Sorbit
hinzugefügt. Dieser ist den Monosacchariden chemisch verwandt und
besitzt eine geschmacklich ähnliche, wenn auch geringere
Süße. Allerdings sollte man bei einer Diät
berücksichtigen, dass dieser Stoff etwa so energiereich ist, wie
die Zucker selbst und damit auch zur Gewichtszunahme beiträgt.
Versuche:
Unterscheiden von Zucker und Süßstoffen
IV. Stärke (Polysaccharide)
Stärke wird aus Kartoffeln und Getreide gewonnen.
Kartoffelstärke wird häufig als Kartoffelmehl zum Backen
verwendet. Maisstärke ist vorwiegend in Soßenbindern,
Reisstärke in Wäschestärke enthalten. Mehl ist ein
Stärkeprodukt, welches aus verschiedenen Getreidesorten, wie z. B.
Weizen und Roggen gewonnen wird.
Versuche:
Gewinnung von Stärke aus Kartoffeln (Versuch 1)
Eigenschaften von Stärke (Versuch 2)
Nachweis von Stärke in Lebensmitteln
Stärke ist aus miteinander verknüpften a-Glucosebausteinen (Bild 3) aufgebaut und damit ein Polysaccharid. Sie enthält einen in Wasser löslichen Anteil (die Amylose) und einen unlöslichen Anteil (das Amylopektin). Die Amylose (ca. 20%) besteht aus Makromolekülen von 250-300 a-Glucosebausteinen und bildet unverzweigte Ketten, während die Makromoleküle des Amylopektins (ca. 80%) aus mehreren tausend a-Glucosebausteinen aufgebaut ist und verzweigte Ketten bildet.
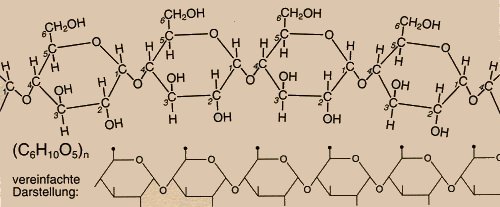
Bild 5: Struktur der Makromoleküle von Stärke (Ausschnitt)
(Quelle: Cornelsen)
Versuche:
Hydrolyse von Stärke
Enzymatische Spaltung von Kartoffelstärke
Herstellen eines Dextrinkleisters
V. Cellulose (Polysaccharide)
Cellulose ist der wichtigste Gerüstbaustoff der Pflanzen.
Die Makromoleküle der Cellulose bestehen aus 6.000-12.000
verknüpften b-Glucosebausteinen (Bild 3 und Bild 6), die unverzweigte
Molekülketten bilden.
Die freien Hydroxygruppen der Cellulose-Molekülketten
bilden mit ihren Nachbarn Wasserstoffbrückenbindungen aus, so dass sich mehrere Ketten zu stabilen
Cellulosefasern bündeln.
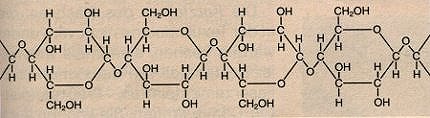
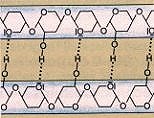
Bild 6: Struktur der Makromoleküle von Cellulose und Cellulosefasern (Ausschnitte)
(Quelle: Cornelsen)
Cellulose ist oft mit anderen Gerüststoffen (z. B. dem harzähnlichen
Lignin und Hemicellulosen) vergesellschaftet, wodurch die stabilen Cellulosefasern nochmals verstärkt werden.
Reine Cellulose findet sich in den Samenhaaren der Baumwollpflanze
und in den Fasern von Flachs und Hanf, die sich gut zu Fäden spinnen lassen und so zu Baumwollstoffen
verarbeitet werden.
Versuche:
Nachweis von Cellulose
Hydrolyse von Cellulose
Herstellen von Pergamentpapier
Holz besteht zu einem großen Teil aus Cellulose, der Holzcellulose. Aus ihr werden Taschentücher, Kaffeefilter, Servietten, Papier und auch Watte aus Holzzellstoff hergestellt. Um die Cellulose von den Gerüststoffen Lignin und Hemicellulose zu trennen, wird das Holz aufgeschlossen.
Papier: Experimente zur Gewinnung von Holzcellulose und deren Verarbeitung
Nachwachsende Rohstoffe: Experimente zur Gewinnung von Holzcellulose und deren Verarbeitung
Holzcellulose wird heute auch als Rohstoff zur Herstellung von Textilfasern genutzt. Da die Holzcellulose aber nicht ohne weiteres zu Fäden gesponnen werden kann, muss sie zunächst gelöst und anschließend in einem Fällbad zu Fäden gesponnen werden. Die so gewonnenen Cellulosefasern nennt man Regeneratfasern; Viskose ist ein Beispiel für eine auf diesem Weg hergestellte Regeneratfaser.
Versuch:
Herstellen einer Regeneratfaser aus Cellulose
Weitere Texte zum Thema „Chemie im und ums Haus“